Optische Fasern in der Medizintechnik
PD Dr. Ronald Sroka, Laser-Forschungslabor, Klinikum Großhadern der Universität München.
Seit Einführung des Lasers in die Medizin und der Entwicklung von Lichtwellenleiter-Technologien werden neue medizinische Anwendungsfelder sowohl in der Diagnostik als auch in der Therapie erschlossen. Diese reichen von invasiven und nicht-invasiven Behandlungen über endoskopische chirurgische Eingriffe bis hin zu bildgebender Diagnostik bei sogenannten Schlüssellochtechniken. Während für diagnostische Zwecke meist geringe Lichtleistungen durch optische Fasern geführt werden, ist bei chirurgischen Eingriffen eher die Übertragung von hohen Leistungen bis 200W im cw-Betrieb gefragt. Eine große Herausforderung für die klinische Nutzung stellt die medizinische Zertifizierung der Lichtwellenleiter dar.
Typische chirurgische Laseranwendungen sind in der Urologie die endoskopische Vaporisation und Enukleation der benignen Prostata sowie die Fragmentierung von Nierensteinen; in der Pulmonologie die endoskopische Zerstörung und Entfernung von tumorösem Gewebe in den Bronchialästen, die endoluminale Verödung von Krampfadern sowie Gewebeabtragung im Nasen- und Rachenraum.
Für derartige Operationen werden Endoskope genutzt, welche ihrerseits mit optischen Fasern ausgestattet sind: einerseits um Licht in das Hohlorgan zu leiten, um dort sehen zu können, andererseits um die Bildinformation mittels geordneter Bildleiterbündel aus dem Hohlorgan zum Okular und so zum Betrachter zu führen.
Anforderungen an Lichtwellenleiter
in der Medizintechnik
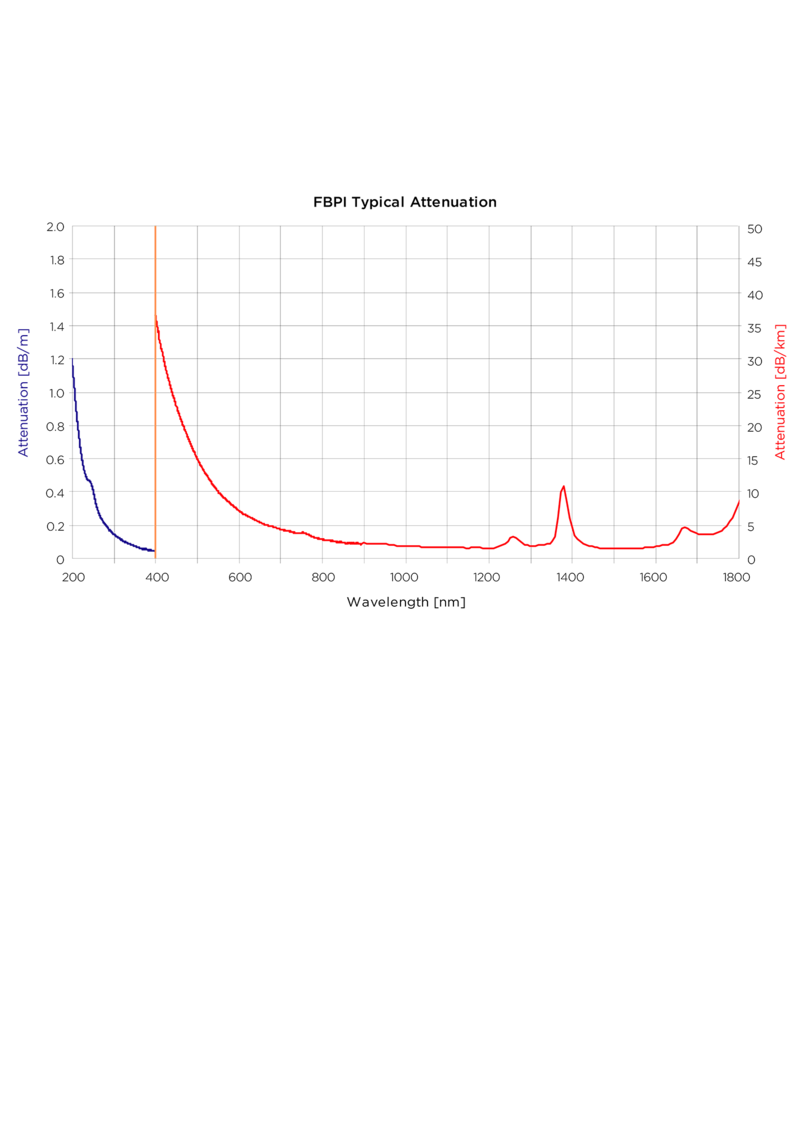
Für chirurgische Eingriffe werden Lichtwellenleiter genutzt, die für die Transmission von hohen Lichtleistungen bei Wellenlängen von 500 nm bis 2500 nm optimiert sind. Dabei wird sowohl gepulste als auch kontinuierliche Strahlung transportiert. Der Lichtwellenleiter wird durch den Arbeitskanal eines Endoskops bis in das Organ hineingeführt, um dort unter Sicht die Laserenergie auf das Gewebe abzugeben. Bei flexiblen Endoskopen ist darauf zu achten, dass der Lichtwellenleiter die Flexibilität und Biegefähigkeit des Endoskops nur geringfügig beeinträchtigt. Aus diesem Grunde werden Lichtwellenleiter mit kleinem Kerndurchmesser (200 – 400 µm) gegenüber steiferen Fasern (600 – 800 µm) bevorzugt. Der Außendurchmesser sollte 1000 µm nicht überschreiten, damit zusätzlich Absaugung bzw. Spülung über den belegten Arbeitskanal erfolgen kann. Basierend auf den Kenntnissen der Licht-Gewebe-Wechselwirkung können von der applizierten Leistungsdichte abhängige Gewebeeffekte und somit Behandlungseffekte induziert werden.
Effektive Steinzertrümmerung mit 2 µm Laserlicht
Beyond Borders

2 µm LASERSTRAHLUNG FÜR DIE MODERNE CHIRURGIE
Neueste chirurgische Prozeduren nutzen Laserlicht der Wellenlänge um 2 µm. Die Domäne der gepulsten Ho:YAG-Laserstrahlung ist die Nierensteinzerstörung (Lithotripsie) in der Urologie. Kontinuierliche und gepulste Strahlung von Thulium Lasern wird bei der Zerstörung von Weichgewebe zur Freilegung der Atemwege in den Bronchialästen genutzt.
NIERENSTEINE MIT LASERLICHT ZERSTÖREN
Die Einführung der Ho:YAG-Laser Technologie hat das Behandlungsspektrum in der urologischen Steinzerstörung revolutioniert und ist heutzutage etabliert [1,2]. In Kombination mit den Entwicklungen des urologisch endoskopischen Instrumentariums hat dieses minimal invasive Verfahren die offene Chirurgie für derartige Behandlungen nahezu verdrängt.
HO:YAG LASERSYSTEME MIT OPTISCHEN FASERN WERDEN BEVORZUGT
Es werden Ho:YAG-Lasersysteme mit optischen Fasern von 365 µm bis 600 µm bei semirigiden Endoskopen verwendet, während bei flexiblen Endoskopen Lichtwellenleiter mit Kerndurchmesser von 220 µm genutzt werden, um Flexibilität und Spülung während der Behandlung zu gewährleisten. Die Komplikationsrate bei Ho:YAG-Laser gestützten Steinzerstrümmerung ist gering. Da sich mittels Ho:YAG-Laserstrahlung alle Steinarten fragmentieren lassen, ist die Ho:YAG-Laser-Lithotripsie die bevorzugte Behandlungsform geworden, auch im Vergleich zu anderen Verfahren wie mittels Ultraschall, pneumatische Zerstörung oder auch anderen gepulsten Lasertypen [3].
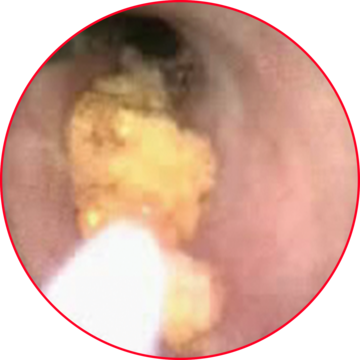
Der technische Fortschritt ermöglicht es heute bis in die Nierenkelchgruppe hinein endoskopische Stein-Behandlungen mittels der Ho:YAG - Laserstrahlung durchzuführen [2,4,5,6,7] (siehe Abb. Lichtwellenleiter mit Stein).
MECHANISMUS DER STEINZERSTÖRUNG
Der Mechanismus der Steinzerstörung beruht dabei insbesondere auf der hohen Absorption des Lichtes dieser Wellenlänge in Wasser. Einerseits wird unmittelbar vor dem Lichtwellenleiter eine Kavitationsblase erzeugt: Dies ermöglicht den freien Weg der Laserstrahlung zum Stein. Ferner kann beim Kollaps der Blase eine Druckwelle erzeugt werden, die zur Disruption des Steines führen kann.
Ho:YAG-Laserstrahlung, die bis zum Stein vordringt, wird vom Wasser im Stein absorbiert, es dehnt sich dabei aus und sorgt so für eine thermische Zersplitterung. Diese Mechanismen gehen mit der Erzeugung von kleinen Fragmenten einher, welche von der Spülflüssigkeit oder vom Urin selbst aus dem Urogenitaltrakt herausgespült werden [8,9,10].
LASERTECHNOLOGIEN IN DER LUNGENHEILKUNDE
In der Pulmologie wurden bisher hauptsächlich Nd:YAG-Laser (1064 nm) bei der interventionellen endoskopischen Chirurgie eingesetzt [11,12,13,14].
GEWEBEABLATION
Die Nd:YAG Wellenlänge dringt relativ tief in Gewebe ein, wird jedoch von dunklen Strukturen (z.B. Blut, Karbonisierungen) stark absorbiert. Dadurch entstehen häufig rasch expandierende Dampftaschen im Gewebe, die unkontrolliert aufreißen und gegebenenfalls die Sicht auf das Operationsgebiet verschlechtern.
Im Gegensatz dazu wird die 2 µm-Strahlung von Thulium-Lasern vom Gewebewasser absorbiert, also relativ unabhängig von der optischen Farbe, und besitzt somit nur eine geringe optische Eindringtiefe. Dies ermöglicht eine oberflächliche präzise und vom Anwender kontrollierte und vorhersagbare Gewebeablation. [15,16,17,18]
Studienergebnisse von invasiven Eingriffen
an der Lunge mit 2 µm Laserlicht
Im Rahmen von Studien wurden erste Erfahrungen mit dem Thulium-Laser bei der interventionellen Pulmonologie gesammelt. Das Laserlicht der Wellenlänge 1940 nm wurde dabei über flexible Lichtwellenleiter mit Kerndurchmesser 365 µm durch den Arbeitskanal des flexiblen Bronchoskopes zum Behandlungsort geführt. Aufgrund der hohen Wasserabsorption wurden sehr definierte und präzise Lasereffekte in Form von Koagulation und Ablation im Gewebe erreicht. Dabei lagen die Koagulationstiefen bei 1 – 2 mm und waren relativ unabhängig von der eingestrahlten Leistung, wohingegen bei Nd:YAG-Behandlungen unkontrollierte tiefe Koagulationsbereiche erzeugt werden.
Die klinischen Erfahrungen zeigten, dass kleine oberflächliche Läsionen komplett abgetragen werden konnten. Tiefe Koagulationen wurden durch Einstechen des Lichtwellenleiterendes in das zu behandelnde, das Lumen einschränkende, Gewebe erzeugt, und befanden sich nur in unmittelbarer Umgebung des Lichtwellenleiterendes. Das so koagulierte Gewebe konnte hinterher einfach und ohne Blutung mechanisch abgetragen werden.
Im Falle von Strikturen konnten Laser-Einschnitte unblutig und gezielt in das einwachsende Gewebe gesetzt werden; dies erfolgte durch mehrmaliges Hin- und Her-Bewegen des Lichtwellenleiterendes über den Einschnitt-Ort während der Laseremission. Selbst Gewebe, welches durch die Maschen von Implantat-Stents in das Lumen hineingewuchert ist, konnte, wie aus der Abbildung hervorgeht, ohne wesentliche Beschädigung des Stentmaterials abgetragen werden. Somit konnten eingewachsene Stents ohne weitere Gewebeschädigungen geborgen werden.
Diese neuartigen Operationstechniken werden in Vollnarkose durchgeführt, damit zusätzlich die Beatmung und die Absaugung in optimaler Form ermöglicht wird. Die Verwendung flexibler Bronchoskope ermöglicht dabei das präzise Führen des Lichtwellenleiters im Bereich des Operationsfeldes [19].
Schließlich sollte noch erwähnt werden, dass Laserbehandlungen nur bei dem spezialisierten und ausgebildeten Mediziner zum gewünschten Erfolg führen, wenn das Wissen und die Erfahrung
des Anwenders inklusive dem sicheren und achtsamen OP-Management hinsichtlich Lasersicherheit zusammenwirkt [20,21,22].
Behandlungen mit 2 µm-Lasern im chirurgischen Bereich zeigen bisher vielversprechende Vorteile gegenüber konventionellen Techniken. Derartige minimal invasive Behandlungsstrategien können nur durch die fortwährenden technologischen Bemühungen hinsichtlich Optimierung der Fasertechnologie unter Berücksichtigung von Biokompatibilität, Flexibilität, Unzerbrechlichkeit ermöglicht werden.
Die enge interdisziplinäre Zusammenarbeit von Forschungseinrichtungen, Industrie und medizinischem Anwender ermöglicht hochpräzise Applikationen von Laserstrahlung im Operationssaal für eine verbesserte Patientenbehandlung und zum Wohle des Patienten.
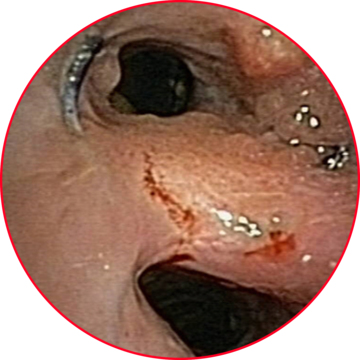
1. Bronchoskopische Aufnahme eines eingewachsenen Metallstents.
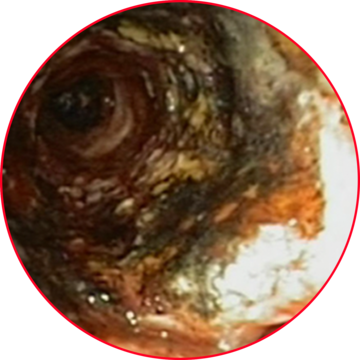
2. Thulium-Laser assistierte Freilegung des Stents.
3. Bronchus nach Bergen des Stents zeigt koaguliertes Granulationsgewebe.
(Geserich W., Fertl A., Häußinger K. Laser bronchoscopy in pre-existing airway stents using a thulium laser (1.9 µm). Poster auf Kongress 2016)
Quellen
Beyond Borders


PD Dr. Ronald Sroka, Laser-Forschungslabor, LIFE-Zentrum, Klinikum Großhadern
Nach seinem Diplom in der Physik engagiert PD Dr. Ronald Sroka sich in der Forschung und Entwicklung der Fluoreszenzdiagnostik, Photodynamischen Therpie (PDT) und Laserchirurgie in nahezu allen medizinischen Fachdisziplinen. Als Forschungsgruppenleiter für Klinische Laseranwendungen verantwortete er die Einbringung neuartiger Laserbehandlungen in den klinischen Alltag. Hierzu gehörten bspw. Laser-Lithotripsy in der Urologie oder die PDT bei Prostata-Krebs. Seit 2010 leitet R. Sroka das Laserforschungslabor der LMU am Großklinikum Großhadern.
1. Breda A, Ogunyemi O, Leppert JT, Schulam PG: Flexible ureteroscopy and laser lithotripsy for multiple unilateral intrarenal stones. Eur Urol 2009, 55:1190–1196.
2. Grasso M, Conlin M, Bagley D: Retrograde ureteropyeloscopic treatment of 2 cm. or greater upper urinary tract and minor staghorn calculi. J Urol 1998, 160:346–351
3. Bader MJ, Eisner B, Porpiglia F, Preminger GM, Tiselius HG: Contemporary management of ureteral stones. Eur Urol 2012, 61:764–672.
4. Kijvikai K, Haleblian GE, Preminger GM, de la Rosette J: Shock wave lithotripsy or ureteroscopy for the management of proximal ureteral calculi: an old discussion revisited. J Urol 2007, 178:1157–1163.
5. Pierre S, Preminger GM: Holmium laser for stone management. World J Urol 2007, 25:235–239.
6. Sofer M, Watterson JD, Wollin TA, Nott L, Razvi H, Denstedt JD: Holmium: Yag laser lithotripsy for upper urinary tract calculi in 598 patients. J Urol 2002, 167:31–34.
7. Hollenbeck BK, Schuster TG, Faerber GJ, Wolf JS: Flexible ureteroscopy in conjunction with in situ lithotripsy for lower pole calculi. Urology 2001, 58:859–863.
8. Bader MJ, Gratzke C, Hecht V, Schlenker B, Seitz M, Reich O, Stief CG, Sroka R: Impact of collateral damage to endourologic tools during laser lithotripsy–in vitro comparison of three different clinical laser systems. J Endourol 2011, 25:667–672.
9. Ronald S, Nicolas H, Thomas P, Volkmar H, Derya T, Stief CG, Markus Jürgen B: In vitro investigations of repulsion during laser lithotripsy using a pendulum set-up. Lasers Med Sci 2012, 27:637–643.
10. Khoder W, Bader M, Sroka R, Stief C, Waidelich R. Efficacy and safety of Ho:YAG Laser Lithotripsy for ureteroscopic removal of proximal and distal ureteral calculi. BMC Urology 2014, 14:62
11. Bolliger CT, Sutedja TG, Strausz J, Freitag L. Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J. 2006;27:1258-71.
12. Gesierich W. Diagnostic and therapeutic laser applications in pulmonary medicine—a review. Med Laser Appl. 2010;25:5-13.
13. Cavaliere S, Foccoli P, Farina PL. Nd:YAG laser bronchoscopy. A five-year experience with 1,396 applications in 1,000 patients. Chest. 1988;94:15-21.
14. Cavaliere S, Venuta F, Foccoli P, Toninelli C, La FB. Endoscopic treatment of malignant airway obstructions in 2,008 patients. Chest. 1996;110:1536-42.
15. Hale GM, Querry MR. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 1973;12:555-63.
16. Wieliczka DM, Weng S, Querry MR. Wedge shaped cell for highly absorbent liquids: infrared optical constants of water. Appl Opt. 1989;28:1714-9.
17. Kou L, Labrie D, Chylek P. Refractive indices of water and ice in the 0.65- to 2.5-microm spectral range. Appl Opt. 1993;32:3531-40.
18. Khoder WY, Zilinberg K, Waidelich R, Stief CG, Becker AJ, Pangratz T, et al. Ex vivo comparison of the tissue effects of six laser wavelengths for potential use in laser supported partial nephrectomy. J Biomed Opt. 2012;17:068005.
19. Gesierich W, Reichenberger F, Fertl A, Haeussinger K, Sroka R. Endobronchial therapy with a thulium fiber laser (1940 nm). J Thorac Cardiovasc Surg 2014;147:1827-32
20. IEC 60825–1 –Ed. 2.0:2007–03: Safety of laser products –Part 1: Equipment Classification and Requirments. Geneva, Switzerland: International Electrotechnical Commission. www.iec-normen.de.
21. Penny J, Smalley RN, CMLSO: Laser safety: risks, hazards, and control measures. Laser Ther 2011, 20(2):95–106.
22. DIN EN 60825–1: 2008–05: Sicherheit von Lasereinrichtungen – Teil 1: Klassifizierung von Anlagen und Anforderungen (IEC 60825–1:2007).
Berlin: Beuth Verlag: Deutsche Fassung EN; 2007:60825–1. in German.
Produktübersicht
Komponenten für medizinische Laser

Klicken Sie hier
LASER COMPONENTS Germany – Ihr kompetenter Partner für optische und optoelektronische Komponenten in Deutschland.
Willkommen bei der LASER COMPONENTS Germany GmbH, Ihrem Experten für Komponenten in der Photonik. Unser breites
Produktsortiment an Detektoren, Laserdioden, Lasermodulen, Optik, Faseroptik und mehr ist jeden Euro (€/EUR)
wert. Mit maßgeschneiderten Lösungen decken wir alle denkbaren Anwendungsbereiche ab: von der Sensortechnik bis
zur Medizintechnik.
Sie erreichen uns hier:
Werner-von-Siemens-Str. 15
82140 Olching
Deutschland
Tel.: +49 8142 2864-0
E-Mail: info(at)